5 - Ciencias Naturales Sexto - Tabla Periódica
La tabla periódica
Con el objetivo de afianzar el uso de la tabla periódica y despejar posible dudas que se tengan en cuanto a su uso y lectura, a continuación estudiaremos nuevamente en qué consiste esta herramienta y cómo la podemos utilizar.
La tabla periódica actual constituye una de las claves para comprender la química y, por
ello, es de gran importancia que los alumnos se familiaricen con su estructura y puedan
manejarla con facilidad.
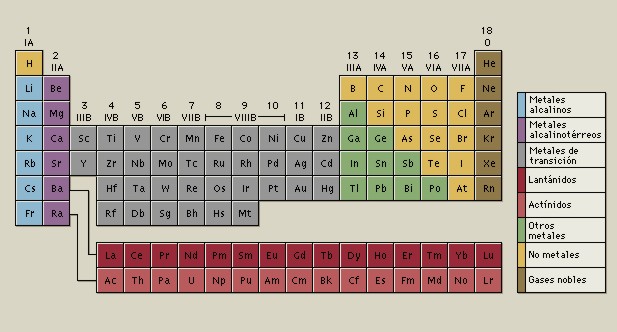
La tabla periódica organiza los elementos químicos en orden de su número atómico. El número atómico es el número total de protones que tiene cada átomo de ese elemento, que es igual al número de electrones. A las columnas de la tabla se les denomina grupos y a las filas los períodos.
Los elementos se disponen en grupos verticales (1-18) y en períodos horizontales (1-7).
La mayor parte de los elementos son metales.
Los no metales se localizan hacia la parte derecha superior.
En la zona diagonal frontera entre metales y no metales se sitúan los metaloides.
Los seis elementos metaloides son: Si, Ge, Sb, Se y Te
Elementos naturales: son elementos químicos encontrados en la naturaleza.
Elementos sintéticos: son elementos químicos cuyos átomos son producidos artificialmente.
Fuente original: Escuelapedia.com
Ejemplo de lectura de la tabla periódica
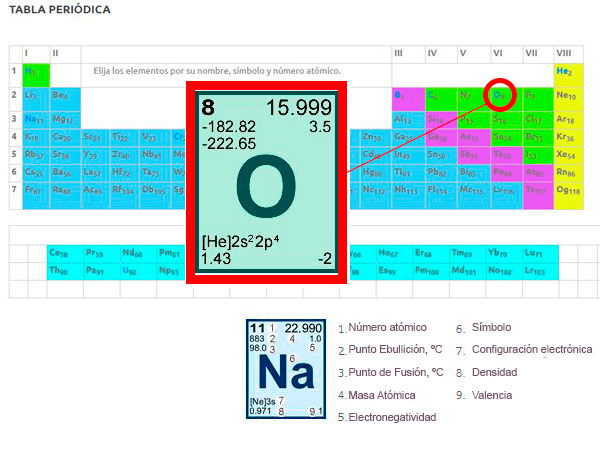
Ejemplo 1. Vamos a buscar en la tabla periódica el elemento químico llamado Oxígeno:
Nombre
|
Oxígeno
|
Símbolo
|
O
|
Grupo
|
VIA
|
Período
|
2
|
Número atómico
|
8
|
Número protones
|
8
|
Número electrones
|
8
|
Masa atómica
|
15.99
|
Ejemplo 2: Ahora buscaremos el elemento químico llamado Plata:
Nombre
|
Plata
|
Símbolo
|
Ag
|
Grupo
|
IB
|
Período
|
5
|
Número atómico
|
47
|
Número protones
|
47
|
Número electrones
|
47
|
Masa atómica
|
107.86
|

Ejemplo 3: Elemento químico Francio:
Nombre
|
Francio
|
Símbolo
|
Fr
|
Grupo
|
IA
|
Período
|
7
|
Número atómico
|
87
|
Número protones
|
87
|
Número electrones
|
87
|
Masa atómica
|
223.01
|




Comentarios
Publicar un comentario