Actividad 2 - Ciencias Naturales - Química Noveno - Ecuaciones químicas
Actividad
Balanceo de ecuaciones químicas
Balancear significa igualar el número de átomos de los reaccionantes con los que
se producen. Toda ecuación química debe cumplir con este principio para estar
correctamente escrita, cumpliendo con una de las leyes fundamentales de la
química, la ley de la conservación de la materia.
Ejemplo 1:
H2
+ O2 → H2O
2H2
+ O2 → 2H2O
Ejemplo 2:
CH4 + 2O2 → CO2 + 2H2O
Ejemplo 3:
HNO3 → N2O5 + H2O
2HNO3 → N2O5 + H2O
2HNO3 → N2O5 + H2O
P4O10 + H2O → H3PO4
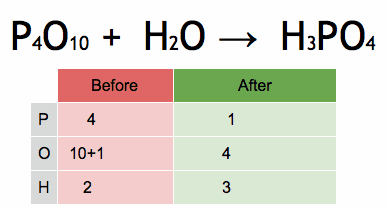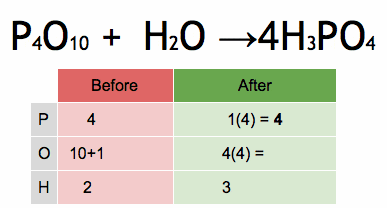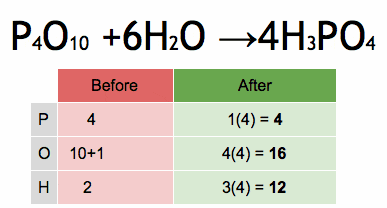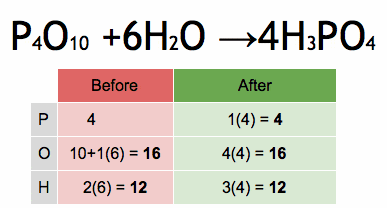
P4O10 + 6H2O → 4H3PO4
Los números que se colocan delante de los átomos o compuestos reciben el
nombre de coeficientes estequiométricos, y su función es igualar la cantidad de
átomos del lado de los reaccionantes y del lado de los productos. Son números
siempre positivos y por lo general se prefiere utilizar enteros.
Recomendaciones antes de balancear:
- Verificar que la ecuación que estés copiando en tu cuaderno la hayas escrito correctamente a partir de la fuente. Tratar de balancear algo mal escrito podría resultar en un quebradero de cabeza y en ocasión imposible de balancear.
- Cerciorarse que está bien formulada, es decir cumpla con las leyes de la nomenclatura química. El no hacer esto resultaría en una gran pérdida de tiempo.
- Revisar si la ecuación ya está balanceada.
EJERCICIOS
Balancear las siguientes ecuaciones químicas, nombrar cada compuesto químico e indicar los estados de oxidación.
- C2H6 + O2 → CO2 + H2O
- Ca + HCl → CaCl2 + H2
- Al + O2 → Al2O3
- PbS + O2 → PbO + SO2
- Sb + HCl → SbCl3 + H2


Comentarios
Publicar un comentario